

联烯不仅是多种有机转化中的重要中间体,而且在天然产物、药品和分子材料中广泛存在,因此一系列方法被成功开发来合成这类化合物。然而,传统的两组分反应存在一系列缺点,比如需要苛刻的反应条件和需要预先官能团化的不饱和起始原料,这极大地限制了其广泛应用。虽然目前可以通过多组分反应对1,3-烯炔进行氧化还原中性双官能团化来构建多取代联烯,但对空气敏感的有机金属亲核试剂的依赖和对高温的要求仍是较大的缺点。因此,发展温和条件下高化学选择性和高区域选择性的1,3-烯炔双碳官能团化新方法意义重大,也因此是有机合成中的前沿研究方向。
近期,有机电化学作为一个高效的策略,利用可再生的电作为氧化还原“试剂”,被成功用于构建各种碳碳和碳杂键。另一方面,两个亲电试剂之间的还原偶联反应由于避免了使用空气敏感的有机金属试剂,成为了传统氧化还原中性方法的良好替代。综合这两种策略的优点,电化学还原偶联有望成为解决上述问题的理想方法。
基于这些考虑,化学学院岳会锋教授和阿卜杜拉国王科技大学 Magnus Rueping 教授合作开发了一种电化学三组分还原性1,3-烯炔的双碳官能团化反应。芳基烷基化和非对称双烷基化反应都可以以良好的化学选择性和区域选择性实现。选择三级烷基溴对该反应的成功实现至关重要,由于位阻效应,它可以抑制芳基溴和烷基溴的两组分交叉偶联副反应,从而生成期望的三组分串联产物。三级和一级烷基溴因其还原电势和位阻效应不同导致激活模式不同,所以该组合确保了1,3-烯炔的非对称双烷基化的成功。
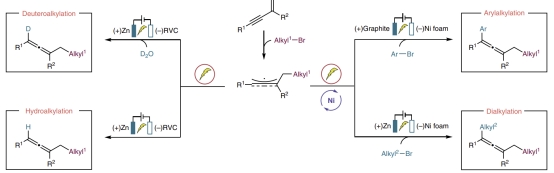
在优化过程中,作者发现在牺牲性供体TMEDA存在的情况下,使用石墨/泡沫镍作为电极对芳基烷基化转化的高产率至关重要。该反应底物范围非常广泛,贫电子、电中性和含杂环的芳基卤代物以及带有芳基或烷基的1,3-烯炔都可以顺利参与该反应。双烷基化的兼容性也非常出色,结构多样的烷基溴都可以成功应用于该转化。此外,该工作还实现了1,3-烯炔的氢烷基化,并且D2O的加入可以使该反应高效的生成更有意义的氘代烷基化产物。
总的来说,该工作实现了1,3-烯炔的芳基烷基化、非对称双烷基化、氢烷基化,以及更重要的氘代烷基化反应。这种温和高效的电化学方法为合成结构和功能各异的联烯化合物提供了一个多功能的平台。这个反应具有广泛的官能团容忍性和良好的化学选择性和区域选择性,使得它在合成含联烯的天然产物和药物类似物等复杂分子方面具有较大的应用潜力。例如,一种包含杂环酰亚胺、吡喃半乳糖和雌酮基团的复杂联烯分子也以较高的产率被成功合成。
该成果以“Electrochemical chemo- and regioselective arylalkylation, dialkylation and hydro(deutero)alkylation of 1,3-enynes”为题发表在Nat. Synth. 2023, https://doi.org/10.1038/s44160-023-00349-9上,化学学院岳会锋教授和阿卜杜拉国王科技大学 Magnus Rueping 教授为共同通讯作者。